BALANCEO DE ECUACIONES
METODOS DE BALENCEO DE ECUACIONES
PRESENTADO POR:
LAURA VANESSA GUZMAN CONTRERAS
GRADO:10-2
INSTITUCION EDUCATIVA EXALUMNAS DE LA PRESENTACION
QUIMICA
IBAGUE -TOLIMA
2017

INTRODUCCION
Una Ecuación Química es la representación gráfica o simbólica de una
reacción que muestra las transformaciones que sufren las substancias,
elementos o compuestos, bajo ciertas condiciones específicas. De esta
manera, las substancias reaccionan tes (llamadas reactivos) sufren una
serie de transformaciones en el curso de una reacción química para dar
origen a los productos de la reacción.
La ecuación química también nos muestra la cantidad de substancias o
elementos que intervienen en la reacción.
Una reacción Química se define como todo proceso en el cual una o más
substancias sufren transformaciones químicas.
Una ecuación química consta de dos miembros constituyentes.
A la izquierda se ubican las substancias que reaccionan y a la derecha,
los productos de la reacción. Para separar ambos miembros, se emplea
una flecha que indica el sentido en que transcurre la reacción.
En la siguiente reacción:
Fe + S → FeS
Un átomo de hierro se combina con un átomo de azufre para dar origen a
una molécula de sulfuro ferroso.
Observe que en ambos miembros de la ecuación existe el mismo número
de átomos. Un átomo de hierro y un átomo de azufre lo que se ajusta a
la Ley de la conservación de la materia, propuesta por Lavoisier en 1774,
que dice lo siguiente:
"En una reacción química, la masa de los reactantes es igual a la
masa de los reactivos" por lo tanto "La materia no se crea ni se
destruye, solo se transforma"
Decimos entonces que la reacción está Igualada o Balanceada.
Una ecuación estará correctamente escrita cuando esté balanceada.
La ecuación:
S + O2 → SO2
Se lee diciendo que un átomo de azufre reacciona con una molécula de
oxígeno para dar lugar a una molécula de Anhídrido sulfuroso.
Obsérvese que el símbolo de oxígeno esta seguido del subíndice “dos”.
Esto se debe a que todas las substancias gaseosas siempre se
representan como moléculas: O2, N2, H2, Cl2, etc. Puede decirse,
entonces que “todas las substancias gaseosas son moléculas
diatómicas”.
Esta reacción también está balanceada pues existe el mismo número de
átomos entre los reactantes y en los productos.
Sin embargo, esto no siempre es así.
Observe la siguiente ecuación:
Mg + HCl → MgCl2 + H2↑
En primer lugar, debemos indicar que la flecha apuntando hacia arriba
que aparece a continuación del símbolo de la molécula de hidrógeno, “↑”,
indica que el hidrógeno es un gas que se desprende a la atmósfera.
En otros casos, podemos encontrar una flecha apuntando hacia abajo,
“↓”, lo cual indica que el elemento o compuesto que la precede, precipita
depositándose en el fondo del recipiente en el que ha ocurrido la
reacción.
Si observamos la ecuación, notaremos que no está balanceada pues a la
derecha de la ecuación hay más átomos de hidrógeno y de cloro que
entre los reactivos.
Para solucionar este problema, debemos multiplicar la molécula de ácido
clorhídrico, “HCl” del primer miembro, por dos:
Mg + 2HCl → MgCl2 + H2↑
Ahora la ecuación ha quedado balanceada pues existen dos átomos de
hidrógeno y dos átomos de cloro a ambos lados de la ecuación.
Este número que antecede al HCl se denomina “Coeficiente” y observe
que afecta a cada constituyente de la molécula por igual (2HCl indica que
hay 2 átomos de H y 2 átomos de Cl). Por el contrario, en el caso del
MgCl2, el subíndice solo afecta al átomo de cloro y no al átomo de
Magnesio (1 átomo de Mg y 2 átomos de Cl).
Este procedimiento de igualar el número de átomos que existe en ambos
lados de la ecuación de denomina “Balanceo de Ecuaciones”.
Existen diversos métodos de igualación de ecuaciones químicas a saber:
- Método por Tanteo
- Métodos de Igualación de Reacciones de Óxido Reducción
- Método algebraico/ matemático
En el presente documento expondremos cada uno de estos métodos y se
proponen un buen número de ejercicios que nos permitirán adquirir las
destrezas necesarias para dominar cada uno de ellos.

OBEJETIVOS
- Evidenciar la existencia de una reacción química.
- Identificar las características de una reacción química y la Información que da una ecuación química.
- Mostrar la forma de escribir una ecuación química balanceada para una reacción química
MARCO TEORICO
MÉTODOS DE BALANCEO DE ECUACIONES
MÉTODO POR TANTEO

Como se ha indicado antes, para balancear por este o todos los demás
métodos es necesario conocer la ley de la conservación de la materia,
propuesta por Lavoisier en 1774.
Como todo lleva un orden a seguir, éste método resulta más fácil si
ordenamos a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígenos
Hidrógenos
De esta manera, nos resulta más fácil, ya que el mayor conflicto que se
genera durante el balanceo es causado principalmente por los oxígenos e
hidrógenos.
Balancear por el método de tanteo consiste en colocar números grandes
denominados "Coeficientes" a la izquierda del compuesto o elemento del que se trate. De manera que “Tanteando”, logremos una equivalencia
o igualdad entre los reactivos y los productos.
Ejemplo: Balancear la siguiente ecuación química:
Fe2O3 + H2O → Fe(OH)3
Para balancear, comenzamos contando los átomos diferentes a oxígeno
e hidrógeno, luego los O2 y finalmente H2.
A la izquierda de la flecha tenemos los “Reactivos” y a la derecha, los
“Productos de la Reacción”. La flecha se lee: “produce”.
Observamos que en los reactivos tenemos dos átomos de hierro (el
número delante del símbolo, Fe. Es importante hacer notar que si el
número está antes de la fórmula del compuesto, afectará a todos los
elementos que lo integran y este número se llamará “coeficiente”. El
coeficiente indica el número de moleculas presentes). En los productos
solo hay un átomo de hierro. Como debe haber el mismo número de
átomos a la izquieda y a la derecha, colocaremos un coeficiente en el
segundo miembro para balancear el número de átomos, así:
Fe2O3 + H2O → 2 Fe(OH)3
NOTA: Observa que solo podemos colocar coeficientes para balancear
(números antes de la formula. No se puede colocar un dos despues del
hierro de los productos pues esto alteraría la formula del compuesto).
Ya hemos igualado los átomos de hierro.
A continuación, contamos los átomos de oxígeno que hay en ambos
lados de la ecuación.
En el primer miembro hay cuatro átomos de oxígeno. Tres en el óxido
férrico (FeO3) y uno en la molécula de agua; mientras que en el segundo
miembro hay seis, tres en el grupo OH multiplicado por el coeficiente 2
que hemos colocado en el paso anterior. (Observa que los coeficientes
multiplican los átomos presentes en la molécula).
Para compensar esta diferencia colocamos un tres antes de la formula del
agua. Lo colocamos allí porque si lo colocamos antes de la formula del óxido, alteraríamos la cantidad de hierro que ya hemos ajustado en el
paso anterior.
Fe2O3 + 3 H2O → 2 Fe(OH)3
Colocamos un tres porque ya hay tres átomos de oxígeno en la
formula del Óxido Férrico.
Contamos ahora los átomos de hidrógeno y observamos que hay seis
átomos a ambos lados de la flecha, por lo que la ecuación ha quedado
balanceada.
Para comprobar, construimos la siguiente tabla:
2 Fe 2
6 O 6
6 H 6

BALANCEO DE ECUACIONES DE ÓXIDO REDUCCIÓN

Se denomina reacción de óxido-reducción o, simplemente, “Redox”, a
toda reacción química en la que uno o más electrones se transfieren
entre los reactivos, provocando un cambio en sus estados de oxidación.
Para que exista una reacción de óxido-reducción, por tanto, debe haber
un elemento que ceda electrones, y otro que los acepte:
- El elemento que cede electrones se oxida, su número de oxidación disminuye y se denomina agente reductor.
- El elemento que acepta electrones, aumenta su número de oxidación, se dice que se reduce y se denomina agente oxidante.
Principio de electro neutralidad
El principio de electro neutralidad de Pauling es un método aproximado
para estimar la carga en moléculas o iones complejos. Supone que la
carga siempre se distribuye en valores cercanos a 0 (es decir, -1, 0, +1).
Dentro de una reacción global redox, se da una serie de reacciones
particulares llamadas semirreacciones o reacciones parciales.
- Semi-reacción de reducción: 2e- + Cu2+ → Cu0
- Semi-reacción de oxidación: Fe0 → Fe2+ + 2e
o
más comúnmente, también llamada ecuación general:
Fe0
+ Cu2+ → Fe2+ + Cu0
La tendencia a reducir u oxidar a otros elementos químicos se cuantifica
por el potencial de reducción, también llamado potencial redox.
Una titulación redox es una en la que un indicador químico indica el
cambio en el porcentaje de la reacción redox mediante el viraje de color
entre el oxidante y el reductor.
Número de oxidación
El número de oxidación es un número entero que representa el número
de electrones que un átomo pone en juego cuando forma un enlace
determinado.
1. Todos los elementos libres que no formen compuesto, tendrán
número de oxidación cero
2. El hidrógeno tendrá número de oxidación de +1 excepto en hidruros
en los cuales actúa con número de oxidación -1
3. El oxígeno tendrá número de oxidación -2 excepto en los peróxidos
donde actúa con número de oxidación -1
4. Los Metales Alcalinos (Grupo IA de la Tabla Periódica) tienen en
sus compuestos número de oxidación +1
5. Los Metales Alcalino Térreos (elementos del Grupo IIA de la Tabla
Periódica) tienen en sus compuestos número de oxidación +2
6. Los halógenos (Grupo VII A) tienen en sus compuestos como
haluros, número de oxidación -1
7. La suma de los números de oxidación de todos los átomos de un
compuesto iónico es igual a la suma de la carga neta de los átomos
constituyentes del ión
8. Si algún átomo se oxida su número de oxidación aumenta y cuando
un átomo se reduce, su número de oxidación disminuye
9. La suma de los números de oxidación de los átomos que
constituyen una molécula es cero
Método de Balanceo del Número de Oxidación.


- Determinación del número de oxidación.
Para comprender este método, vamos a balancear la siguiente ecuación:
Fe + H2SO4 → Fe2 (SO4)3 + H2↑
La primera regla, esta nos dice que todos los elementos libres tendrán
valencia cero, luego, localizamos los elementos libres, en este caso son
el Hierro y el hidrógeno, y colocamos un cero como valencia.
Fe0
+ H2SO4 → Fe2 (SO4)3 + H2
0
↑
Continuamos con las demás reglas y ubicamos a los oxígenos e
hidrógenos y les asignamos la valencia que les corresponde, según se
estableció en las reglas:
Fe0
+ H2
+1 SO-2
4 → Fe2 (SO-2
4)3 + H2
0
↑
Para continuar, obtenemos la valencia de los elementos restantes, en
este caso el azufre y el hierro:
Ubiquémonos en el azufre (S) del primer miembro en la ecuación
H2
+1 SO-2
4
Para obtener la valencia del azufre, simplemente vamos a multiplicar la
valencia del oxígeno por el número de oxígenos que hay (en este caso
hay 4 oxígenos que multiplicados por el -2 del número de oxidación,
resulta -8) y hacemos lo mismo con el hidrógeno, multiplicamos su
valencia por el número de oxígenos que hay (2 átomos de hidrógeno
multiplicados por +1 resulta +2). Queda de la siguiente manera:
H2
+1 S
X O
-2
4
Se plantea una ecuación de primer grado, recordando que la suma de los
números de oxidación de los átomos integrantes de la molécula debe ser
igual a cero:
2 x (+1) + X + 4 x (-2) = 0
+2 + X -8 = 0
X = +8 - 2
X = + 6
Resulta que la valencia del azufre ha de ser +6. Comprobamos:
+2 + 6 - 8 = 0
Ubiquémonos ahora el hierro del segundo miembro:
Fe2 (SO-2
4)3
Esta sal está formada por un catión, (Fe) y un anión, en este caso, el ión
sulfato (SO4).
Si recordamos las reglas de formulación, es fácil deducir que la valencia
del hierro es +3 y la del ión sulfato -2 (observe los subíndices delante de
cada ión). Ya hemos definido el número de oxidación del hierro. Falta
conocer el número de oxidación del azufre en el ión sulfato.
Ya sabemos que la carga neta del ión es -2, por lo que si se multiplica los
cuatro átomos de oxígeno por -2, resulta que la carga del oxígeno es -8,
por lo que es lógico deducir que el número de oxidación del azufre será
+6 para que al hacer la suma algebraica resulte -2.
Y de esta manera ya hemos obtenido todas las valencias del compuesto
químico:
Fe0
+ H2
+1S
+6O
-2
4 → Fe+3
2 (S+6O
-2
4)
-2
3 + H2
0
↑
Ahora, vamos a verificar cuál elemento se oxida y cual se reduce. Observamos que el hierro se oxida pues su número de oxidación
aumenta de cero a 3 (pierde 3 electrones):
Fe0
+ H2
+1 S
+6 O
-2
4 → Fe+3
2 (S+6 O
-2
4)
-2
3 + H2
0
↑
Observamos ahora que el hidrógeno se reduce (gana 1 electrón), pero
como hay dos átomos de hidrógeno, se multiplica por 2):
La ecuación queda de la siguiente manera:
Fe0
+ H2
+1S
+6O
-2
4 → Fe+3
2 (S+6O
-2
4)
-2
3 + H2
0
↑
↓ ↑
Se oxida 3e-
Se reduce
3e-
1x2e-
= 2e
A
continuación, intercambiamos estos números que indican la perdida y/o
ganancia de electrones como se indica a continuación:
2Fe0
+ 3H2
+1S
+6O
-2
4 → Fe+3
2 (S+6O
-2
4)
-2
3 + H2
0
↑
Ahora contamos el número de átomos a ambos lados de la ecuación:
2= Fe =2
3= S =3
12= O =12
6= H =2
Para compensar el déficit de hidrógenos del segundo miembro,
multiplicamos este elemento por 3
2Fe + 3H2SO4 → Fe2 (SO4)3 + 3H2 ↑
La ecuación balanceada resulta:
2Fe + 3H2SO4 → Fe2 (SO4)3 + 3H2 ↑
Otro ejemplo del mismo caso anterior se presenta a continuación:
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Asignamos los números de oxidación:
K
+1Mn+7O4
-2
+ H+1Cl-1 → K+1Cl-1
+ Mn+2Cl2
-1
+ Cl2
0
+ H2
+1O
-2
Observemos que en el segundo miembro, el cloro aparece con dos
valencias, por tanto, comenzaremos el balanceo por ese lado de la
ecuación:
K
+1Mn+7O4
-2
+ H+1Cl-1 → K+1Cl-1
+ Mn+2Cl2
-1
+ Cl2
0
+ H2
+1O
-2
↑
↓
5 e- 1 ex
2 = 2 e
KMnO4
+ HCl → KCl + 2MnCl2 + 5Cl2 + H2O
Ajustamos la ecuación en el primer miembro y efectuamos las
correcciones que hagan falta:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
La mayoría de las reacciones químicas elementales ocurren en disolución
acuosa. En estos casos, no se indican todos los reactivos o productos
sino que normalmente solo se presentan el agente oxidante y el agente
reductor; en qué se convierten y el medio en el que se realiza la reacción
(disolución básica o ácida), por esta razón, la reacción deberá ser
completada.
Se recomienda seguir el siguiente procedimiento:
1. Asignar los números de oxidación siguiendo las reglas ya
estudiadas.
2. Igualar la ecuación con la proporción adecuada de agente oxidante
y agente reductor.
3. Contar los átomos de oxígeno a ambos lados de la ecuación y
añadir moléculas de agua donde exista déficit de O2.
4. Contar los átomos de hidrógeno y completar con protones (H+
) en el
lado deficiente.
5. Si se indica que la reacción se realiza en medio ácido, se deja así,
sin embargo, si se indica que la reacción ocurre en medio básico,
se deben añadir tantos OHa
ambos lados de la ecuación como
protones se han incorporado en el paso anterior.
6. Sumar los H+ y los OHagregados
y convertirlos en H2O y
finalmente, eliminar las especies que se repitan a ambos lados de la
ecuación.
Como ejemplo, igualemos la siguiente reacción sabiendo que ocure en
medio ácido:
Cr2O7
=
+ H2SO3 → Cr+3 + HSO4
-
Iniciamos colocando los números de oxidación según el procedimiento ya
estudiado: (solo indicaremos los números de oxidación del agente
oxidante y el reductor)
Cr2
+6O7
=
+ H2S
+4O3 → Cr+3 + HS+6O4 -
Balanceamos los átomos de Cromo del segundo miembro:
Cr2
+6O7
=
+ H2S
+4O3 → 2Cr+3 + HS+6O4
-
↑
↓
3 ex
2 = 6 e-
2 e-
Se reduce Se oxida
(ag. oxidante) (ag. Reductor)
La relación entre los reactivos es 6:2, por lo que simplificamos resultando
3:1 y balanceamos:
Cr2O7
=
+ 3H2SO3 → 2Cr+3 + 3HSO4
-
Verificamos los átomos de oxígeno y detectamos un déficit de 4 átomos a
la derecha que compensamos con agua:
Cr2O7
=
+ 3H2SO3 → 2Cr+3 + 3HSO4
-
+ 4 H2O
Ahora tenemos un déficit de 5 Hidrógenos a la derecha que
compensamos con H+
:
5 H+
+ Cr2O7
=
+ 3H2SO3 → 2Cr+3 + 3HSO4
-
+ 4 H2O
Verificamos las cargas eléctricas a ambos lados de la ecuación y
confirmamos que están balanceadas.
Puesto que la reacción ocurre en medio ácido, concluimos en este punto:
5 H+
+ Cr2O7
=
+ 3H2SO3 → 2Cr+3 + 3HSO4
-
+ 4 H2O
Estudiemos ahora un ejemplo de reacción en medio básico. Balancear y completar la siguiente reacción sabiendo que ocurre en
medio básico:
CrO4
=
+ SO3
= → Cr(OH)4
-
+ SO4
=
Cr+6O4
=
+ S+4O3
= → Cr+3(OH)4
-
+ S+6O4
=
↑ ↓
3 e-
2 e-
Se oxida Se reduce
(ag. Reductor) (ag. oxidante)
Balanceamos según la relación encontrada:
2CrO4
=
+ 3SO3
= → 2Cr(OH)4
-
+ 3SO4=
Compensamos el déficit de oxígeno:
3H2O + 2CrO4
=
+ 3SO3
= → 2Cr(OH)4
-
+ 3SO4=
Compensamos el déficit de hidrógeno:
2H+
+ 3H2O + 2CrO4
=
+ 3SO3
= → 2Cr(OH)4
-
+ 3SO4=
Como el medio es básico, agregamos a ambos lados de la reacción,
tantos OH como
protones se agregaron en el paso anterior
2 OH-
+ 2H+
+ 3H2O + 2CrO4
=
+ 3SO3
= → 2Cr(OH)4
-
+ 3SO4= + 2OH
Sumamos
estas especies:
2 H2O + 3H2O + 2CrO4
=
+ 3SO3
= → 2Cr(OH)4
-
+ 3SO4= + 2OH-
5H2O + 2CrO4
=
+ 3SO3
= → 2Cr(OH)4
-
+ 3SO4= + 2OH
Verificamos
que las cargas estén balanceadas y concluimos:
5H2O + 2CrO4
=
+ 3SO3
= → 2Cr(OH)4
-
+ 3SO4= + 2OH-

- Método de Balanceo del Ión-electrón o Semi-reacciones.
Este es un procedimiento particularmente útil para reacciones en
disolución, aunque también puede emplearse en racciones en estado
gas-sólido.
Deben seguirse los siguientes pasos:
1. Identificar el agente oxidante y el agente reductor, recordando que
el elemento que pierde electrones es el que se oxida y es a su vez,
el agente reductor; el elemento que gana electrones es el que se
reduce y es, a su vez, el agente oxidante.
2. Mostrar mediante semi reacciones cómo se reduce el agente
oxidante y como se oxida el agente reductor.
3. Asegurarse que los átomos diferentes a oxígeno e hidrógeno estén
igualados y corregir de ser necesario.
4. Contar los átomos de oxígeno a ambos lados de la semi-reacción y
compensar déficit con moléculas de agua.
5. Agregar protones, H+
, al lado deficiente en hidrógeno.
6. Contar las cargas eléctricas y multiplicar cada semi-reacción por un
coeficiente conveniente para que, al sumar ambas semi reacciones,
se igualen las cargas y puedan eliminarse.
7. Si la reacción ocurre en medio básico, agregar tantos OHa
ambos
lados de la semi reacción, como protones (H+
) se agregaron para
compensar déficits de hidrógeno (paso 5).
8. Combinar los OHy
los H+
y eliminar el agua que aparezca
duplicada en la reacción.
9. Sumar ambas semi reacciones y eliminar las especies que
aparezcan duplicadas en la reacción final.
Ejemplos:
Balancear la siguiente ecuación por el método de las semi reacciones:
KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O
Asignamos los números de oxidación:
K
+1Mn+7O4
-2
+ H+1Cl-1 → Mn+2Cl2
-1
+ Cl2
0
+ K+1Cl-1
+ H2
+1O
-2
Mn+7 + 5e-
→ Mn+2
(agente oxidante)
2Cl-1 → Cl2
0
+ 2 e-
(agente reductor)
Multiplicamos la primera semi reacción por 2 y la segunda por 5:
2 x (Mn+7 + 5e-
→ Mn+2)
5 x (2Cl-1 → Cl2
0
+ 2 e-
)
2Mn+7 + 10e-
→ 2Mn+2
10Cl-1 → 5Cl2
0
+ 10 e
2Mn+7 + 5Cl-1
+ 10 e- → 2Mn+2 + 5 Cl2
0
+ 10 e-
2KMnO4 + 10HCl → 2MnCl2 + 5Cl2 + KCl + H2O
Balanceamos el Potasio del segundo miembro:
2KMnO4 + 10HCl → 2MnCl2 + 5Cl2 + 2KCl + H2O
Ajustamos el oxígeno:
2KMnO4 + 10HCl → 2MnCl2 + 5Cl2 + 2KCl + H2O + 7 H2O
Las moléculas de agua pueden sumarse
2KMnO4 + 10HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Se ajusta el hidrógeno:
6H
+
+ 2KMnO4 + 10HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Ya que estos protones solo pueden provenir del ácido, sumamos a la
especie correspondiente:
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Reajustamos el cloro:
2KMnO4 + 16HCl → 2MnCl2 + 8Cl2 + 2KCl + 8H2O
La ecuación está ahora balanceada.
Es muy frecuente encontrar en los libros de texto y/o en literatura técnica
ecuaciones expresadas en forma iónica.
En estos casos se procede así:
Balancear la reacción:
Zn + NO3
-
+ H3O
+
→ Zn+2 + NH4
+
+ H2O
Para balancear este tipo de reacciones, primero, reescribimos la ecuación
omitiendo el ión hidronio (H3O
+
) y el agua:
Zn + NO3
-
→ Zn+2 + NH4
+
Asignamos los números de oxidación:
Zno
+ N+5O3
-
→ Zn+2 + N-3H4
+
Se escriben las semi reacciones y se identifican los agentes oxidante y
reductor:
Zn0 → Zn+2 + 2 e-
(agente reductor)
N
+5O3
-
+ 8 e- → NH4
+
(agente oxidante)
4 x (Zn0 → Zn+2 + 2 e-
)
N
+5O3
-
+ 8 e- → NH4
+
4Zn0
→ 4Zn+2 + 8 e
-
N
+5 O3
-
+ 8 e-
→ NH4
+
4Zn + NO3
-
+ 8 e- → 4Zn+2 + NH4
+
+ 8 e
Se
eliminan los electrones:
4Zn + NO3
- → 4Zn+2 + NH4
+
Reintroducimos el agua y el ión hidronio:
4Zn + NO3
-
+ H3O
+
→ 4Zn+2 + NH4
+
+ H2O
Se igualan las cargas eléctricas:
4Zn + NO3
-
+ 10H3O
+
→ 4Zn+2 + NH4
+
+ H2O
Se compensa el déficit de oxígeno con moléculas de agua:
4Zn + NO3
-
+ 10H3O
+ → 4Zn+2 + NH4
+
+ 13H2O
La ecuación esta ahora correctamente balanceada.
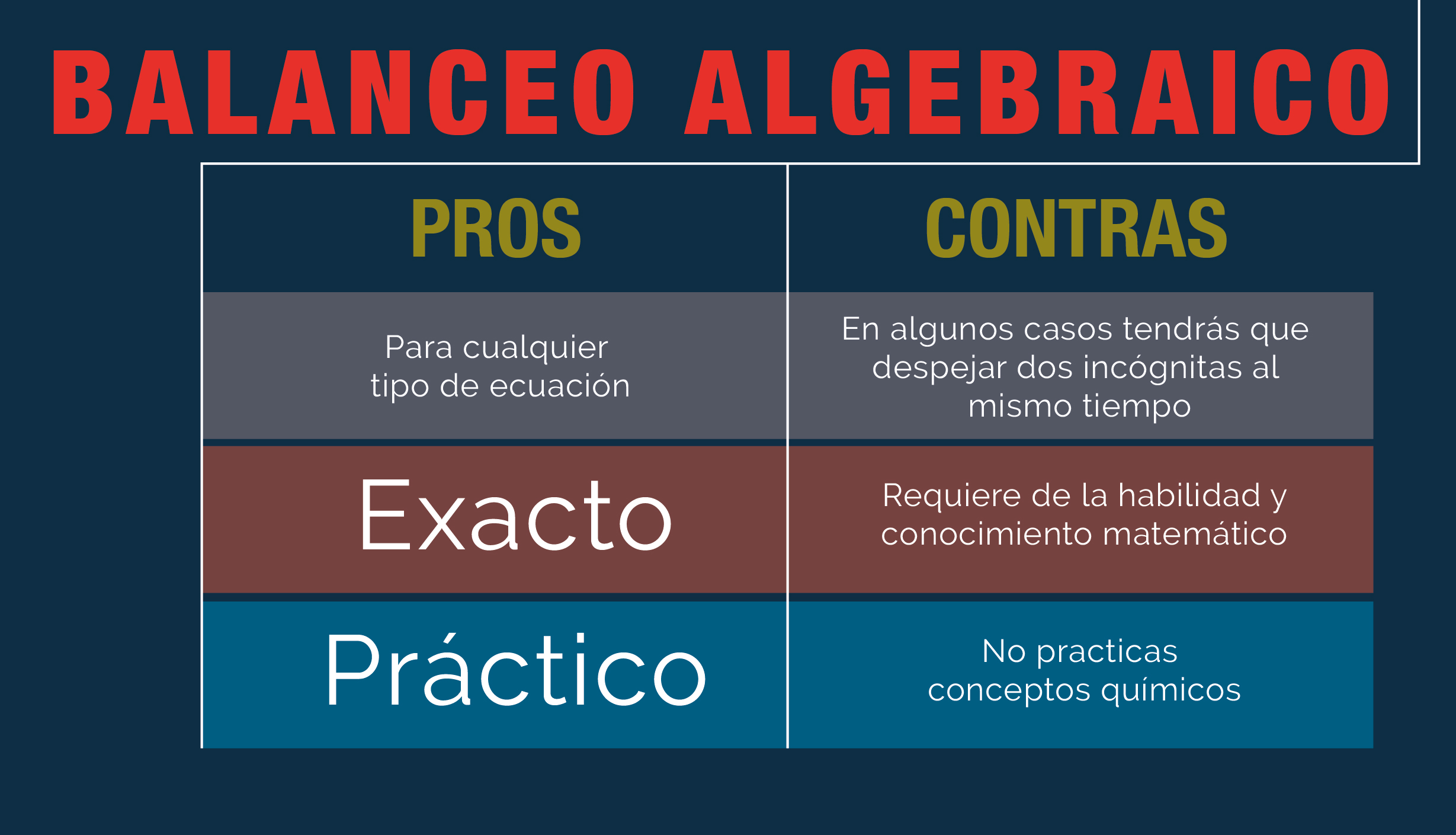
BALANCEO POR EL MÉTODO ALGEBRAICO/ARITMÉTICO

Se siguen los siguientes pasos:
- Escribir antes de cada molécula una letra, siguiendo el orden alfabético.
- Enlistar verticalmente los átomos que participan en la reacción
- A la derecha del símbolo de cada elemento que participa se escribe el número de veces que el elemento se encuentra en cada molécula identificada por letra.
- Si de un lado de la reacción un elemento se encuentra en más de una molécula, se suman y se escribe cuantas veces está presente en una molécula
- Se cambia la flecha por un signo igual =
- Se enlistan las letras que representan las moléculas y a la letra más frecuente se le asigna el valor de uno
- Los valores de las letras se obtienen por operaciones algebraicas
Ejemplo:
Balancear la siguiente ecuación:
CaC2 + H2O → Ca(OH)2 + C2H2
Aplicamos la primera regla o paso:
a CaC2 + b H2O → c Ca(OH)2 + d C2H2
Aplicamos el segundo paso:
Ca
C
O
H
Continuamos con el tercer paso:
Ca: (Ca está en "a" del primer miembro y en "c" en el segundo por lo
tanto)
a=c
C: (C está 2 veces en "a" y 2 veces en "d" por lo tanto)
2a = 2d
O: (O está en "b" y 2 veces en "c" por lo tanto)
b = 2c
H: (H está 2 veces en "b", 2 en "c" y 2 veces en "d" por lo tanto)
2b = 2c + 2d
PROCEDIMIENTO
CONCLUSIONES
Finalmente sabemos que las reacciones químicas representan un evento de la realidad, porque, siguen una ley universal “la materia no se crea ni se destruye solo se transforma”.
También sabemos que una ecuación es la representación simbólica de las reacciones y que si los átomos no son de la misma cantidad tanto de reactivos como de productos la ecuación esta desequilibrada.
Todas estas reacciones suceden en alguna actividad de nosotros por ejemplo: al descomponerse la acidula de sodio mediante energía se separa el sodio y en nitrógeno: es lo que sucede cuando choca un carro
Finalmente podemos concluir esta investigación seremos capaces de balancerar correctamente cualquier ecuación química por el proceso de tanteo, así como
También podremos reconocer si una ecuación química se encuentra correctamente balanceada y tendremos la capacidad de poder transmitir nuestros nuevos conocimientos a otros estudiantes.
También podremos reconocer si una ecuación química se encuentra correctamente balanceada y tendremos la capacidad de poder transmitir nuestros nuevos conocimientos a otros estudiantes.

WEBGRAFIA
http://www.monografias.com/trabajos83/balanceo-ecuaciones-quimicas/balanceo-ecuaciones-quimicas.shtml
https://es.slideshare.net/aeroscristh/balanceo-de-ecuaciones-qumicas-30434345
Comments
Post a Comment