REACCION QUIMICA Y ECUACION QUIMICA
REACCIÓN QUÍMICA Y ECUACIÓN QUÍMICA
PRESENTADO POR:
LAURA VANESSA GUZMAN CONTRERAS
GRADO:10-2
INSTITUCION EDUCATIVA EXALUMNAS DE LA PRESENTACION
QUIMICA
IBAGUE -TOLIMA
2017
INTRODUCCIÓN
Hablamos de reacción química cuando las moléculas de los reactivos rompen alguno de
sus enlaces para formar otros nuevos, lo que conlleva la aparición de nuevas sustancias.
Llamamos ecuación química a la expresión en la que aparecen como sumando las
fórmulas de los reactantes (sustancias que reaccionan) seguidas de una flecha, y las
fórmulas de los productos (sustancias que se producen) también sumándose.
Deben incluirse los estados de agregación de las sustancias, aunque si todas están en
disolución o son gaseosas, se pueden obviar.
Para que se produzca la reacción es necesario que las moléculas de los reactantes
choquen entre sí, ya que es la única manera de que puedan intercambiar átomos para dar
los productos. Ésta es una condición necesaria pero no suficiente ya que el choque debe
darse con una mínima energía para que los enlaces de los reactivos se puedan romper, y
con la orientación que les permita unirse para formar las moléculas de los reactivos. Si se
dan todas las condiciones hablaremos de choque efectivo.
En el presente documento mencionare todos los conceptos y saberes que debemos tener para poder identificar estas:
- Definición de reacción química
- Ejemplos
- Ecuación química
- Como se escribe
- Clases de Reacciones Químicas
- Ejemplos
También señalare para que el texto tanga un buen cuerpo de trabajo como lo son los objetivos, las conclusiones y justificación. Esto los desarrollare con el propósito del aprendizaje y la profundización mas acerca de las reacciones químicas.
Objetivos
- Definir las reacciones químicas y ecuación química
- Entender qué sucede en una reacción química.
- Saber clasificar las reacciones.
- Reconocer una reacción química y ecuación
Cuando un ácido reacciona con una base se produce una reacción de neutralización, dando lugar a una sal más agua y desprendiendo energía, son por general reacciones exotérmicas. Por ejemplo, si hacemos reaccionar el ácido clorhídrico con una base como el hidróxido sódico obtenemos cloruro sódico (sal común) más agua.
Objetivos
- Definir las reacciones químicas y ecuación química
- Entender qué sucede en una reacción química.
- Saber clasificar las reacciones.
- Reconocer una reacción química y ecuación
REACCIONES QUÍMICAS
En los procesos en los que existe un cambio físico, la naturaleza básica de las sustancias que
intervienen no sufre ninguna alteración.
Por ejemplo, en los cambios de estado, la sustancia
que cambia de estado sigue siendo la misma: al vaporizar agua líquida obtenemos vapor de
agua, tanto la sustancia que teníamos al inicio –agua líquida– como la que obtenemos al final
del proceso –vapor de agua– son la misma sustancia: agua. No obstante, sus propiedades
físicas cambian de un estado al otro (estado de agregación, conductividad eléctrica,
conductividad térmica, densidad, calor específico, etc.).
En este caso, la sustancia que sufre un
cambio físico, no experimenta ningún cambio en su composición.
Una reacción química (o cambio químico) es un proceso en el cual unas sustancias (o especies
químicas) iniciales, con unas propiedades características determinadas, denominadas
reactivos, se transforman en otras sustancias (o especies químicas) finales, denominadas
productos de la reacción, las cuales tienen otras propiedades características diferentes a las de
los reactivos. Se podría decir que se produce un cambio en la naturaleza básica de las
sustancias.
Las sustancias iniciales y finales son totalmente diferentes.
En las reacciones químicas se producen cambios en la estructura electrónica debidos a la
rotura de enlaces químicos de las especies químicas iniciales (reactivos) y la formación de
nuevos enlaces químicos para formar nuevas sustancias (productos de la reacción). En cambio,
en las reacciones nucleares, los cambios se producen en la estructura nuclear y de su estudio
se ocupa la rama de la Física, conocida como Física Nuclear.
Reactantes: Las sustancias iniciales, y que experimentan el cambio químico, se denominan reactantes.
Las sustancias químicas nuevas y finales y, por tanto, resultantes del cambio químico, se conocen como
productos.
Productos: La ecuación química es la representación gráfica de la reacción química, donde se señalan las sustancias
participantes del cambio, es decir, reactantes y productos. A veces también se especifica el cambio
energético asociado.
Una reacción química lleva asociada una reorganización de los átomos de los
reactivos para formar los productos.
Cambio químico
En el cambio químico, las sustancias químicas (materia) se transforman en otras sustancias diferentes,
debido a que su estructura molecular se altera. Los cambios químicos pueden ser reversibles e irreversibles,
y se realizan y desarrollan a través de un proceso conocido como reacción química.
• Reacción química reversible:
N2 : Nitrógeno gaseoso
H2 : Hidrógeno gaseoso
NH3 : Amoníaco (gaseoso)
a) N2 + H2
1 NH3 b) H2O + CO2
1 H2CO3
H2CO3: ácido carbónico
• Reacción química irreversible:
CO2 + C6H12O6gO2 + H2O NaOH + HClgNaCl + H2O
CO2: Dióxido de carbono
NaOH: Hidróxido de Sodio
C6H12O6 : Glucosa
HCl: Ácido Clorhídrico
O2 : Oxígeno
NaCl: Cloruro de Sodio (sal común)
H2O: Agua
Continuamente se está produciendo innumerables reacciones químicas, desde las que se producen en nuestro organismo a la que se produce en el coche que acaba de pasar o a las que se producen en la cocina. Estas reacciones las podemos clasificar en:
- Reacciones de combinación.
- Reacciones de descomposición.
- Reacciones de sustitución.
- Reacciones de oxidación y reducción.
- Reacciones ácido-base.
Reacciones de combinación
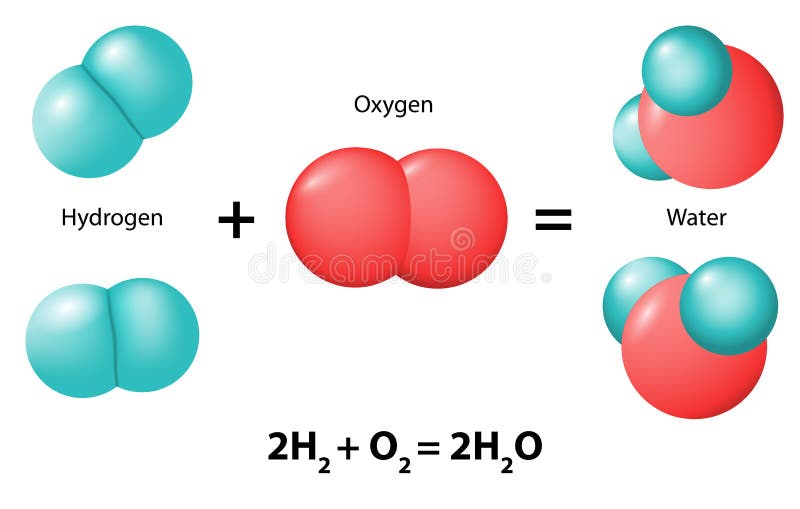
Son reacciones en las que dos o más sustancias reaccionan para formar un único compuesto. Por ejemplo el hidrógeno y el oxígeno reaccionan para dar agua.
2 H2(g) + O2 (g) -> 2 H2O (l)
Reacciones de descomposición
Son reacciones en las que una sustancia se transforma en dos o más sustancias sencillas, para que esto sucede debemos suministrar energía. Si al carbonato de calcio le comunicamos calor, este se descompone en óxido de calcio y dióxido de carbono.
CaCO3 -> CaO + CO2
Otro ejemplo de reacción de descomposición es la electrolisis, donde por acción de la energía eléctrica el agua se descompone en hidrógeno y oxígeno.
Reacciones de sustitución
También se llaman de desplazamiento, son reacciones en las que un elemento de un compuesto es desplazado por otro elemento de otro reactivo. Un ejemplo de este tipo de reacciones es la sustitución del hidrógeno de un ácido por un metal:
Ni (s) + 2 HCl (aq) -> NiCl2 (aq) + H2 (g)
En otras ocasiones se produce un intercambio de elementos entre los reactivos que reaccionan:
3 HCl (aq) + Al(OH)3 (s) -> AlCl3 (aq) + 3 H2 O (l)
Reacciones de oxidación y reducción
Una reacción de oxidación es aquella en la que un elemento o compuesto gana oxígeno:
2 Fe (s) + O2 (g) -> 2 FeO (s)
|
Sin embargo, una reacción de reducción es aquella en la que un compuesto pierde oxígeno. Las dos reacciones se producen al mismo tiempo. En metalurgia son muy importante estas reacciones ya que nos permiten obtener los metales libres que normalmente nos los encontramos en la naturaleza formando óxidos.
FeO (s) + C (s) -> Fe (s) + CO (g)
Las combustiones son un grupo importante de reacciones de oxidación, son reacciones exotérmicas en las que el combustible (gas, madera, gasolina,...) reaccionan con el oxígeno obteniéndose dióxido de carbono y vapor de agua:
CH4 (g) 2 O2 -> CO2 + 2 H2O
|
Una combustión muy importante es la que se produce en nuestro organismo cuando sustancias como la glucosa reaccionan con el oxígeno presente en las células, obteniéndose energía y desprendiéndose dióxido de carbono y agua, es lo que conocemos como respiración celular.
En ocasiones debemos impedir que la reacciones de oxidación se produzcan, sobre todo en algunos productos alimenticios como las grasas o aceites, ya que esta oxidación produce un enranciamiento. Para ello se utilizan los antioxidantes que evitan que se produzcan las reacciones de oxidación no deseadas, por lo mismo utilizamos productos anticorrosión en metales como el hierro.
Reacciones ácido-base
Lo primero que debemos saber es distinguir un ácido de una base
| ÁCIDOS | BASES |
| Presentan un sabor agrio, vinagre | Presentan un sabor amargo, jabón |
| Reaccionan con algunos metales desprendiendo hidrógeno. | Favorecen la disolución de las grasas, por eso se utilizan como detergentes. |
| Reaccionan con carbonatos, como el mármol, desprendiendo dióxido de carbono | Dañan la capa grasa de la piel, de aquí que tengamos que utilizar productos los menos básicos posibles para nuestro aseo |
| Sus propiedades desaparecen cuando reaccionan con una base. | Sus propiedades desaparecen cuando reaccionan con un ácido. |
El grado de acidez o basicidad de una sustancia nos lo da su pH. Es una escala que va desde el 1 al 14, de manera que cuanto menor sea el número más ácida es la sustancia y cuanto mayor sea es más básica. Las sustancias que no son ni ácidas ni básicas tienen un pH = 7 son sustancias neutras, el agua pura. Para medir el pH se utiliza el papel indicador universal que una vez impregnado en la sustancia nos informa del pH a partir del color que este adquiere.
ESCALA DE PH DE LOS COMPUESTOS
| |||||||||||||
ÁCIDOS
<- aumenta la acidez |
NEUTRA
|
BÁSICOS
aumenta la basicidad -> | |||||||||||
Cuando un ácido reacciona con una base se produce una reacción de neutralización, dando lugar a una sal más agua y desprendiendo energía, son por general reacciones exotérmicas. Por ejemplo, si hacemos reaccionar el ácido clorhídrico con una base como el hidróxido sódico obtenemos cloruro sódico (sal común) más agua.
HCl + NaOH -> NaCl + H2O
IDENTIFICACIÓN DE UNA REACCIÓN QUÍMICA
- Desprendimiento de gases
- Formación de precipitado (Formación de material solido)
- Cambios de coloración
- Consumo de material solido
- Desprendimiento de energía solar (Luz o Calor)

- Formación de precipitado (Formación de material solido)
- Cambios de coloración
- Consumo de material solido
- Desprendimiento de energía solar (Luz o Calor)

CARACTERÍSTICAS
-La o las sustancias nuevas que se forman suelen presentar un aspecto totalmente diferente del que tenían las sustancias de partida.
- Durante la reacción se desprende o se absorbe energía: * Reacción exotérmica: se desprende energía en el curso de la reacción. * Reacción endotérmica: se absorbe energía durante el curso de la reacción.
- Se cumple la ley de conservación de la masa: la suma de las masas de los reactivos es igual a la suma de las masas de los productos. Esto es así porque durante la reacción los átomos ni aparecen ni desaparecen, sólo se reordenan en una disposición distinta.

El cambio químico
Características del cambio químico:
Ocurre un cambio químico cuando una
o más sustancias se transforman para dar origen
a otras sustancias
diferentes. El cambio químico puede ser reversible
o irreversible
y está siempre acompañado de un cambio
de energía.
¿Qué sucede en un cambio químico?
Cuando ocurre un cambio químico, los enlaces de los átomos y moléculas reactantes se rompen y se crean nuevos enlaces,
de manera que los átomos se reordenan, formando nuevas
moléculas.
Manifestaciones de una reacción química:
En una reacción química ocurren uno
o varios de los siguientes eventos:
• Emisión de gases.
• Efervescencia.
• Cambio de color.
• Emisión de luz.
• Elevación de la temperatura.
CLASIFICACIÓN DE REACCIONES QUÍMICAS
Encontramos muchísimas reacciones químicas diferentes. puesto que es algo inherente a
la ciencia ordenar y clasificarlo todo, ésta no iba a ser una excepción. Dada esta variedad
hay bastantes formas de clasificar las reacciones.
Vamos a estudiar diversas clasificaciones atendiendo a diferentes criterios. Ten en cuenta
que no son excluyentes: una reacción se puede clasificar con todos y cada uno de los
criterios, como verás al final de la página.
Debido a su importancia, desarrollaremos de forma más extensa dos de los criterios de
clasificación : según la transformación y según la partícula transferida.
Aqui podemos observas algunos tipos de reacciones.
- Según la velocidad con la que que se desarrolla la reacción:
Dependiendo del tiempo que tardan en consumirse los reactivos encontraremos
reacciones rápidas y lentas.
Na + H2
O → NaOH Rápida, tarda muy poco en consumir todo el sodio.
Fe + O2
→ FeO Lenta, el hierro se oxida con el aire a una velocidad baja.
- Según la energía implicada en el proceso:
Si la reacción desprende energía, la denominamos exotérmica y cuando la absorbe
decimos que es endotérmica. Éstas las desarrollamos en el apartado de energía.
H2
+ F2
→ 2 HF Q= -128.4 KJ Desprende calor, es exotérmica.
C + H2
→ C3
H6
Q= 20.4 KJ Absorbe calor, es endotérmica.
-Según el sentido de la reacción:
Si la reacción se da sólo de reactivos a productos, nos referimos a ella como irreversible.
Si se da también de productos a reactivos (en ambos sentidos), hablamos de reversible.
NaOH + HCl → H2
O + NaCl Irreversible, solo se da en este sentido
N2
+ 3H2 ↔ 2NH3
Reversible, hay un equilibrio entre ambas reacciones.
Por ejemplo, el ácido sulfúrico reacciona con la sacarosa de
forma algo lenta. Si añadimos agua a esta mezcla, la
reacción es rápida. Al principio se va oscureciendo poco a
poco y, al añadir agua, se vuelve negra rápidamente. En
ambos casos se desprende energía , es exotérmica e
irreversible.
SEGÚN EL TIPO DE TRANSFORMACIÓN
Las clasificamos según la transformación o mecanismo por el que se da la reacción:
- Reacciones de combinación o síntesis: Partiendo de dos o más sustancias, producen un solo producto:
H2 + O2 → H2O Fe + Cl2 → FeCl3
- Reacciones de descomposición: Partiendo de un solo reactante, da lugar a varios productos:
H2CO3 → CO2 + H2O H2O2 → O2 + H2O
- Reacciones de desplazamiento o sustitución: Son aquellas en las que algún átomo de una de las sustancias que reacciona es desplazado
o sustituido por otro de una sustancia simple:
Na + H2O → NaOH + H2 Co + H2SO4 → H2 + CoSO4
- Reacciones de doble desplazamiento: Es muy parecida a la anterior pero, esta vez, el átomo que entra en la molécula proviene
de un compuesto y el átomo desplazado entra en la molécula del otro compuesto.
H3PO4 + Ca(OH)2 → Ca3(PO4)2+ H2O NaCl + CaNO3 → NaNO3 + CaCl2
SEGÚN LA PARTÍCULA QUE SE TRANSFIERE
Para esta clasificación nos fijaremos en la partícula que pasa de un reactivo a otro.
- Reacciones de transferencia de protones o ácido-base :Utilizaremos la teoría de Arrhenius por ser sencilla, aunque completa, y suficiente para
nuestro objetivo. Consideramos ácido a aquella sustancia capaz de ceder protones (H+
en
disolución, llamado más correctamente ión oxonio y representado por H3O
+
) y base a la
que es capaz de ceder iones hidróxido (OH-
también llamado oxhidrilo).
1) NaOH → Na+
+ OH-
2) HCl → H+
+ Cl
Un ión oxonio de la sustancia con características ácidas se une a un oxhidrilo proviniente
de la sustancia básica para dar agua. Los iones restantes se unen para formar una sal.
1) NaOH + HCl → NaCl + H2O
2) H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O
- Reacciones de transferencia de electrones o de oxidación-reducción:Son aquellas en las que se verifica la transferencia de electrones entre los reactantes. Para saber si ha tenido lugar, hay que observar el número de oxidación.
En este curso será suficiente con adoptar como tal la valencia iónica. Si gana electrones, su número de oxidación disminuye y decimos que se reduce; si los pierde, dicho número aumenta y hablamos de oxidación.
1) FeCl2 + CoCl3 → FeCl3 + CoCl2 Cambian hierro y cobalto
2) KMnO4 + KI + HCl → MnCl2 + KIO3 + KCl+ H2 O Cambian iodo y manganeso
Las combustiones son procesos en los que una sustancia se oxida (combustible) y otra se reduce (comburente) liberando gran cantidad de energía y formando gases.
Es preciso que conozcas las combustiones de hidrocarburos, en las que el carbono pasa a dióxido de carbono y el hidrógeno, a agua. En este caso el comburente es el oxígeno.
1) C6H6 + O2 → CO2 + H2O 2) C3H5OH + O2 → CO2 + H2O
-Irreversible: Reacción química que se genera en una sola dirección, es una reacción directa.
Ejemplo: HCl + NaOH --> NaCl + H2O }
- Reversible: Reacción química que se genera en dos direcciones.
Ejemplo: 2Cl2 + 2H2O --> 4HCl +O2
Vemos que se han ajustado los coeficientes del oxígeno y del agua de manera que ahora tenemos el mismo número de átomos de cada elemento tanto en los reactivos como en los productos.
WEBGRAFIA
http://blocs.xtec.cat/debianita/files/2014/03/REACCIONES-QU%C3%8DMICAS-rev_2013-copia.pdf
http://somoslink.com/pdf/FISICA_QUIMICA_3_ESO_U04_Reacciones_Quimicas.pdf
http://recursostic.educacion.es/newton/web/materiales_didacticos/las_reacciones_quimicas/reacciones/reaccionesaula.pdf
htt|ps://www.monografias.com/docs/Caracteristicas-De-Las-Reacciones-Quimicas-FKQBQGFCDGNZ
http://depa.fquim.unam.mx/amyd/archivero/ResumenReaccionQuimica_15976.pdf
http://www.quimicas.net/2015/11/balanceo-de-ecuaciones-quimicas-ejemplos.html
1) NaOH + HCl → NaCl + H2O
2) H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O
- Reacciones de transferencia de electrones o de oxidación-reducción:Son aquellas en las que se verifica la transferencia de electrones entre los reactantes. Para saber si ha tenido lugar, hay que observar el número de oxidación.
En este curso será suficiente con adoptar como tal la valencia iónica. Si gana electrones, su número de oxidación disminuye y decimos que se reduce; si los pierde, dicho número aumenta y hablamos de oxidación.
1) FeCl2 + CoCl3 → FeCl3 + CoCl2 Cambian hierro y cobalto
2) KMnO4 + KI + HCl → MnCl2 + KIO3 + KCl+ H2 O Cambian iodo y manganeso
Las combustiones son procesos en los que una sustancia se oxida (combustible) y otra se reduce (comburente) liberando gran cantidad de energía y formando gases.
Es preciso que conozcas las combustiones de hidrocarburos, en las que el carbono pasa a dióxido de carbono y el hidrógeno, a agua. En este caso el comburente es el oxígeno.
1) C6H6 + O2 → CO2 + H2O 2) C3H5OH + O2 → CO2 + H2O
SEGÚN LA ENERGÍA CALORIFICADA INVOLUCRADA:
-Endotérmicas: Reacción química en la que se absorbe o requiere calor.
Ejemplo: ∆
FeO + H2 --> Fe + H2O
- Exotérmicas: Reacción química en la que se libera o pierde calor.
Ejemplo:
2 HI --> H2 + I2 + ∆ (calor)
SEGUN EL SENTIDO DE REACCION
Ejemplo: HCl + NaOH --> NaCl + H2O }
- Reversible: Reacción química que se genera en dos direcciones.
Ejemplo: 2Cl2 + 2H2O --> 4HCl +O2
SEGÚN LA VELOCIDAD DE LA REACCIÓN
Reacción lenta: Una reacción química lenta es aquella donde la cantidad de producto formado o la cantidad de reactante consumido por unidad de tiempo es muy pequeña
Ejemplo: Oxidación del hierro a temperatura ambiental.
Reacción rápida: Es aquella donde la cantidad de producto formado o la cantidad de reactante consumido por unidad de tiempo es grande.
Ejemplo: la oxidación del sodio metálico la exponerse al aire
DOBLE SUSTITUCIÓN O DESPLAZAMIENTO DOBLE. Dos especies (elementos, iones) reemplazan a otros dos
en compuestos.
NaOH + HCl NaCl + H2O
IÓNICAS. Una o varias especies se presentan en forma iónica. En contraposición existen las reacciones
moleculares, es decir, no aparecen iones. Los casos anteriores son ejemplos de reacciones moleculares.
Fe+2 + Cl2 Fe+3 + Cl-1
DE OXIDACIÓN – REDUCCIÓN: Uno o más elementos cambian su estado de oxidación. Siembre debe haber
por lo menos una especie que se oxida y una que se reduce.
El apartado 2.5 es un ejemplo de reacción de
oxidación-reducción.
El ión hierro +2 pasa a hierro +3, es decir se oxida. Cloro cambia su estado de oxidación
de cero a -1 es decir se reduce.
ENDOTÉRMICAS. Son reacciones que requieren calor. De lo contrario la reacción no ocurre. Se puede
representar de varias formas.
Veamos:
KClO KCl + O
3(s) (s) 2(g)
KClO3 + calor KCl + O2
EXOTÉRMICAS. Son reacciones que liberan o desprenden calor. Es el caso de todos los combustibles (sólidos,
líquidos o gaseosos).
C3H8 + O2 CO2 + H2O + calor
ECUACIÓN QUÍMICA
Una ecuación química es un enunciado que utiliza fórmulas químicas para describir las identidades y cantidades relativas de los reactivos y productos involucrados en una reacción química.
Para poder representar lo que ocurre en una reacción química mediante una ecuación, ésta debe cumplir con la Ley de la conservación de la materia y con la Ley de conservación de la energía. Es decir, la ecuación debe indicar que el número de átomos de los reactivos y productos es igual en ambos lados de la flecha y que las cargas también lo son. Dicho en otras palabras, se debe contar con una ecuación balanceada.
Por ejemplo en la siguiente ecuación química, analicemos cuáles son las sustancias participantes a lo largo de la ecuación:
PARTES DE LA ECUACIÓN
Las ecuaciones químicas son diferentes de las ecuaciones matemáticas porque las dos partes de una reacción química representan el «antes» y el «después» de una reacción.
En las ecuaciones matemáticas, un signo igual (=) separa las dos partes de la ecuación. En las ecuaciones químicas no se utilizan signos iguales.
En su lugar, una flecha se utiliza para separar los “dos lados” de la ecuación, y apunta en la dirección que una reacción química procederá (Shonberg, S.F.).
Cualquier cambio químico o reacción química se puede representar con la ayuda de ecuaciones, se escriben con la ayuda de la fórmula molecular de reactivos y productos.
Vamos a discutir diferentes tipos de ecuaciones químicas con varios ejemplos. Trate de relacionar estos ejemplos con su vida cotidiana (Carpi, 2003).
Decíamos al principio del artículo que existen tres partes principales en una ecuación química:
- los reactantes
- los productos
- la flecha que indica el sentido de la reacción química.
Los reactantes son los elementos o compuestos que se colocan del lado izquierdo de la flecha, los productos son aquellos que se colocan a la derecha.
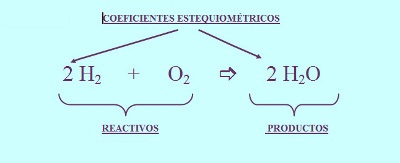
2H2 + O2 -> 2H2O
Lo anterior es un ejemplo de una ecuación química. Lo resaltado en color rojo son los reactantes, lo resaltado en azul son los productos, la flecha que da la dirección de la reacción está en color negro y se usa el símbolo + para separar los elementos o compuestos que reaccionan en una reacción.
Nótese los dos números 2 de color verde. Estos números se llaman coeficientes. Los coeficientes se utilizan para equilibrar las ecuaciones químicas (Petras, S.F.).
En ocasiones, los productos de una reacción química reaccionan entre sí, para producir otra vez los reactantes.
En este caso se dice que la reacción es reversible y que está en equilibrio cuando la velocidad de formación de los productos es igual a la de los reactantes.
Se usa una doble flecha para denotar el doble sentido de la reacción. Nunca debe usar una flecha con dos puntas para este tipo de reacciones puesto que esto significa que hay resonancia, un fenómeno ajeno a una reacción química (Pastore, 2013).
Usualmente, encima de la flecha se suele escribir símbolos para denotar las condiciones en que ocurre la reacción química.
Por ejemplo si hay un símbolo Δ encima de la flecha, quiere decir que la reacción fue calentada.
Si hay un elemento o compuesto químico como por ejemplo el Pt, quiere decir que se usó como catalizador. Si está escrito H2O implica que la reacción es en medio acuoso (Swords, S.F.).
Existe también una simbología que indica el estado de los reactantes y los productos. Si se coloca un (s), (l), (g) o (aq) al lado izquierdo de los reactantes o los productos, esto quiere decir que estos se encuentran en estado sólido, líquido, gaseoso o en disolución acuosa respectivamente.
Adicionalmente se puede usar el símbolo de una flecha hacia abajo para indicar el estado sólido o la formación de un precipitado y el símbolo de flecha hacia arriba para indicar la presencia o formación de un gas de un gas (Symbols in Chemical Equations, S.F.).
Como escribir una ecuación química
Los pasos seguidos para escribir una ecuación química son:
– Los reactivos y productos de la reacción son identificados y anotados.
– La fórmula o símbolos de los reactivos se escriben en el lado izquierdo con un signo ‘+’ entre ellos.
– La fórmula o símbolos de los productos se escriben en el lado derecho con un signo ‘+’ entre ellos.
– Los dos lados (reactivos y productos) se separan por una flecha (→) apuntando hacia los productos.
– Para una reacción reversible, una doble flecha () se utiliza en lugar de una flecha.
– El número de átomos de cada elemento se cuenta en ambos lados. Si son iguales, entonces se denomina una ecuación química balanceada. Si no son iguales, el equilibrio de la ecuación se realiza ajustando los coeficientes antes de los símbolos y la fórmula de los reactivos y productos según la ley de la conservación de la masa.
En términos cualitativos, una ecuación química transmite los nombres de los diversos reactivos y los productos.
En términos cuantitativos, representa el número relativo de átomos y moléculas (especie reactiva y producto) que participan en la reacción, el número relativo de moles de los reactivos y productos, las masas relativas de los reactivos y productos y los volúmenes relativos de reactivos y productos gaseosos.
Así, la ecuación química nos da la relación cuantitativa entre los reactivos y los productos o la estequiometría de la reacción (TutorVista.com, S.F.).
Ejemplo de cómo escribir y balancear una ecuación química
Escribir y balancear la ecuación química para cada reacción química dada.
1- El hidrógeno y el cloro reaccionan para formar HCl.
2- El etano, C2H6, reacciona con el oxígeno para producir dióxido de carbono y agua.
Solución
1- Comencemos simplemente escribiendo una ecuación química en términos de las fórmulas de las sustancias, recordando que tanto el hidrógeno elemental como el cloro son diatómicos:
H2 + Cl2 → HCl
Hay dos átomos de hidrógeno y dos átomos de cloro en los reactivos y uno de cada átomo en el producto. Podemos fijar esto incluyendo el coeficiente 2 en el lado del producto:
H2 + Cl2 → 2HCl
Ahora hay dos átomos de hidrógeno y dos átomos de cloro en ambos lados de la ecuación química, por lo que es equilibrado.
2- Comience escribiendo la ecuación química en términos de las sustancias involucradas:
C2H6 + O2 → CO2 + H2O
Tenemos dos átomos de carbono a la izquierda, por lo que necesitamos dos moléculas de dióxido de carbono en el lado del producto, de modo que cada lado tiene dos átomos de carbono. Ese elemento está balanceado.
Tenemos seis átomos de hidrógeno en los reactivos, por lo que necesitamos seis átomos de hidrógeno en los productos. Podemos conseguir esto por tener tres moléculas de agua:
C2H6 + O2 → 2CO2 + 3H2O
Ahora tenemos siete átomos de oxígeno en los productos (cuatro del CO2 y tres del H2O). Eso significa que necesitamos siete átomos de oxígeno en los reactivos.
Sin embargo, debido a que el oxígeno es una molécula diatómica, sólo podemos obtener un número par de átomos de oxígeno a la vez. Podemos lograr esto multiplicando los otros coeficientes por 2:
2C2H6 + O2 → 4CO2 + 6H2O
Mediante la multiplicación de todo lo demás por 2, no desbalanceamos los otros elementos, y ahora obtenemos un número par de átomos de oxígeno en el producto-14. Podemos obtener 14 átomos de oxígeno en el lado reactivo por tener 7 moléculas de oxígeno
2C2H6 + 7O2 → 4CO2 + 6H2O
Como verificación, cuente todo para determinar que cada lado tiene el mismo número de átomos de cada elemento. Esta ecuación química está ahora balanceada (The Chemical Equation, S.F.).
SÍMBOLOS DE USO COMÚN EN LAS ECUACIONES QUÍMICAS
EJEMPLO:
en la reacción de combustión del metano sabemos que los reactivos son metano y oxígeno y los productos son dióxido de carbono y agua. Así la ecuación química sería:
CH4 + O2 → CO2 + H2O
Sin embargo, en este caso no se cumple la Ley de Conservación de la Materia ya que en los reactivos hay 4 átomos de hidrógeno y 2 de oxígeno mientras que en los productos hay 2 átomos de hidrógeno y 3 de oxígeno. La ecuación balanceada sería por lo tanto:
CH4 + 2O2 → CO2 + 2H2O
CH4 + O2 → CO2 + H2O
Sin embargo, en este caso no se cumple la Ley de Conservación de la Materia ya que en los reactivos hay 4 átomos de hidrógeno y 2 de oxígeno mientras que en los productos hay 2 átomos de hidrógeno y 3 de oxígeno. La ecuación balanceada sería por lo tanto:
CH4 + 2O2 → CO2 + 2H2O
Vemos que se han ajustado los coeficientes del oxígeno y del agua de manera que ahora tenemos el mismo número de átomos de cada elemento tanto en los reactivos como en los productos.
Balanceo de Ecuaciones Químicas:
Existen diversos métodos de balanceo de ecuaciones químicas. A continuación se describen los más empleados:
Existen diversos métodos de balanceo de ecuaciones químicas. A continuación se describen los más empleados:
- Método del Tanteo: este método se basa en que los reactivos y productos de la ecuación de la reacción tengan el mismo número de átomos.
Ejemplo 1: sea la reacción S2 + O2 → SO3
Comprobamos que no hay el mismo número de átomos de los elementos en los reactivos (2 átomos de S y 2 átomos de oxígeno) que en los productos (1 átomo de S y 3 de O).
El siguiente paso consiste en añadir coeficientes por tanteo hasta que coincidan el número de átomos de reactivos y productos. En este caso los pasos que daríamos para balancear la ecuación serían:
- Ajustamos los azufres de los productos para que coincidan con los reactivos: S2 + O2 → 2SO3
- Ajustamos los oxígenos de los reactivos para que coincidan con los 6 de los productos: S2 + 3O2 → 2SO3
- Comprobamos que todos los elementos están ajustados, entonces la ecuación balanceada sería:
S2 + 3O2 → 2SO3
Ejemplo 2: sea la reacción HNO3 → N2O5 + H2O
Para balancearlo por tanteo procedemos de la siguiente manera:
- Ajustamos el reactivo asignándole el coeficiente 2 para que el número de hidrógenos coincida con el de los productos: 2HNO3 → N2O5 + H2O
- Comprobamos y verificamos que el número de átomos de todos los elementos coincide en reactivos y productos, por lo que la ecuación balanceada es:
2HNO3 → N2O5 + H2O
Nota: el método de tanteo es útil y sencillo para ecuaciones con pocos reactivos y productos. En ecuaciones más complejas conviene emplear otros métodos.
- Método de Redox: este método es utilizado para balancear ecuaciones de oxidación reducción cuando es difícil ajustarlo por otros métodos.
Este método se basa en los números o estados de oxidación (NO) de los elementos. Además debemos tener en cuenta las siguientes reglas:
- Los elementos no combinados tienen NO = 0
- En una molécula neutra la suma de NO es 0
- El NO del Hidrógeno combinado vale 1 (excepto en los hidruros metálicos que vale -1)
- El Oxígeno combinado tiene NO = -2 (excepto en los peróxidos que vale -1)
- En compuestos covalentes se aplica NO negativo al elemento más electronegativo
Los pasos a realizar para balancear una ecuación redox son:CONCLUSIONES
- Identificar los átomos que cambian de NO al pasar de reactivos a productos identificando cuáles se oxidan (NO más positivo) y cuáles se reducen (NO más negativo).
- A continuación se escriben las semirreacciones de oxidación y de reducción de cada elemento. Se balancea cada semirreacción indicando también el número de electrones totales que se ganan o se pierden.
- Finalmente se balancean los electrones ganados o perdidos multiplicando la semirreacción de oxidación por el número de electrones ganados del elemento que se reduce y la semirreacción de reducción por el número de electrones perdidos.
En síntesis podemos decir que las reacciones químicas son de suma importancia ya que son fenómenos que vemos a diario en nuestra vida y son la base de la realización de las funciones vitales y las demás actividades del hombre o cualquier otro ser vivo, como por ejemplo la respiración es una reacción química, ya que al organismo entra O2 y sale CO2. Además todas las sustancias que usamos o usan los demás seres vivos fueron producto de reacciones químicas.
Existen varios tipos de reacciones los cuales son: reacción de combinación, de descomposición, de sustitución y de doble sustitución, todos estos muy diferentes pero cumplen la misma función la formación de uno o varias sustancias y/o compuestos nuevos, los cuales pueden ser de mucha utilidad, o también pueden ser dañinos para la naturaleza.
Como fue de esperar pudimos comprobar que toda la teoría que sabíamos y estudiamos, se cumple en la vida, ya que todas las reacciones según su tipo se comportaron como dicen los libros y las personas que conocen el tema, lo cual nos ha permitido reconocer y diferenciar bien los tipos de reacciones químicas.
WEBGRAFIA
http://somoslink.com/pdf/FISICA_QUIMICA_3_ESO_U04_Reacciones_Quimicas.pdf
http://recursostic.educacion.es/newton/web/materiales_didacticos/las_reacciones_quimicas/reacciones/reaccionesaula.pdf
htt|ps://www.monografias.com/docs/Caracteristicas-De-Las-Reacciones-Quimicas-FKQBQGFCDGNZ
http://depa.fquim.unam.mx/amyd/archivero/ResumenReaccionQuimica_15976.pdf
http://www.quimicas.net/2015/11/balanceo-de-ecuaciones-quimicas-ejemplos.html














BUEN TRABAJO 4.8
ReplyDeleteYo le daba la calificacion completa ,aprendi mas con el blog que con mi profe
Delete